曹濟民教授與周鑫教授團隊在《Acta Biomaterialia》發(fā)文:線粒體靶向AIEgen-蛋白納米粒子用于成像引導的腫瘤光動力治療
稿件來源:細胞生理學省部共建教育部重點實驗室 發(fā)布時間:2023-08-19 點擊次數:
近期,,細胞生理學教育部重點實驗室曹濟民教授和周鑫教授團隊在高水平國際學術期刊《Acta Biomaterialia》(中科院一區(qū)top期刊,影響因子10.633)發(fā)表了最新研究成果:《Facile and green fabrication of tumor- and mitochondria-targeted AIEgen-protein nanoparticles for imaging-guided photodynamic cancer therapy》,。青年教師王德平,、博士生鄭健及碩士生蔣芳穎為本文共同第一作者,曹濟民教授和周鑫教授為共同通訊作者,。

近年來,,具有聚集誘導發(fā)光(AIE)性質的活性材料已成為一種很受關注的生物成像和光療手段。然而,,大多數AIE發(fā)光體(AIEgen)需要封裝到多功能納米復合材料中,,以提高其生物相容性和腫瘤靶向性。該研究利用基因工程技術,,將腫瘤歸巢穿透肽LinTT1融合與人鐵蛋白重鏈(HFtn)相融合,,制備出可以靶向腫瘤細胞及其線粒體的蛋白納米籠(LinTT1-HFtn)。將其作為納米載體,,通過pH介導的解離/重組過程封裝AIEgens,,從而制備具有雙靶向功能的AIEgen-蛋白納米粒子。
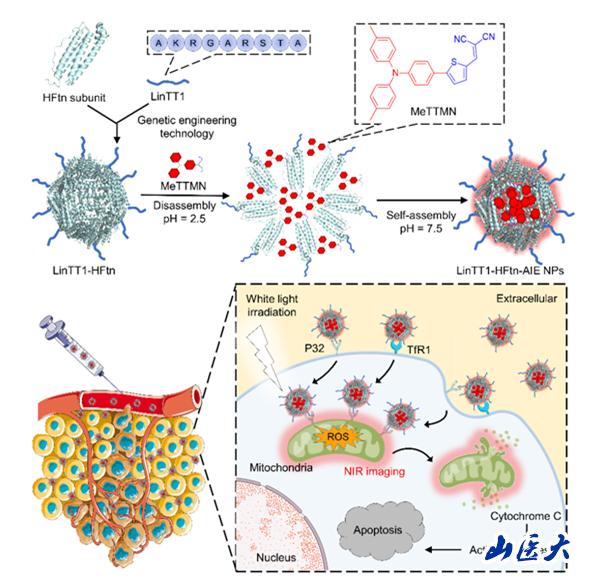
LinTT1- HFtn-AIE NPs的構建及其靶向和治療機制示意圖
LinTT1-HFtn的中空納米空腔結構不僅可以容納多個AIEgen分子,,而且由于與LinTT1-HFtn亞基的相互作用,,限制了AIEgen的分子內運動,因此其熒光強度和ROS生成能力顯著增強,。同時,,蛋白納米籠也賦予AIEgen良好的親水性和生物相容性。由于腫瘤細胞高表達的轉鐵蛋白受體1和P32受體所介導的內吞過程,,該納米粒子比游離AIEgen分子表現(xiàn)出更高的細胞攝取效率,。此外,該納米粒子可以迅速積聚到腫瘤細胞,,特別是線粒體中,,從而誘導線粒體發(fā)生功能障礙,進而導致細胞發(fā)生凋亡,。體內實驗表明,,該納米粒子可對腫瘤進行熒光成像,從而引導精準的光動力治療,,很好的抑制了腫瘤生長,。因此,,本研究提出了一種簡便且綠色的方法來制備靶向腫瘤細胞及其線粒體的AIEgen-蛋白納米粒子,這可以成為熒光成像引導的腫瘤光動力治療的一種有前景的策略,。