我校曹濟(jì)民教授團(tuán)隊(duì)在《Chemical Engineering Journal》發(fā)文:半人工細(xì)菌焦亡誘導(dǎo)劑用于逆轉(zhuǎn)腫瘤微環(huán)境的代謝重編程
稿件來(lái)源:基礎(chǔ)醫(yī)學(xué)院 發(fā)布時(shí)間:2025-03-20 點(diǎn)擊次數(shù):
3月15日,,細(xì)胞生理學(xué)教育部重點(diǎn)實(shí)驗(yàn)室曹濟(jì)民教授團(tuán)隊(duì)在國(guó)際權(quán)威期刊《Chemical Engineering Journal》(中國(guó)科學(xué)院一區(qū)TOP期刊,,影響因子13.3)發(fā)表題為《Semi-artificial bacterial pyroptosiser for reverse the metabolic reprogramming of tumor microenvironment》的合作研究成果。我校王德平教授為共同第一作者,,我校曹濟(jì)民教授,、天津醫(yī)科大學(xué)鄭斌教授及阮先輝教授為共同通訊作者,,我校周鑫教授和碩士生郝英健為共同作者。
腫瘤微環(huán)境中,,腫瘤細(xì)胞與免疫細(xì)胞間的營(yíng)養(yǎng)競(jìng)爭(zhēng)異常激烈,,腫瘤細(xì)胞通過(guò)代謝重編程掠奪葡萄糖資源,導(dǎo)致免疫細(xì)胞能量供給受限,,嚴(yán)重削弱其抗腫瘤活性,。此外,傳統(tǒng)光熱療法雖可殺傷腫瘤,,但腫瘤細(xì)胞可通過(guò)有效的營(yíng)養(yǎng)攝取來(lái)上調(diào)熱休克蛋白(HSPs)的表達(dá),,從而對(duì)熱應(yīng)激產(chǎn)生耐受性,降低光熱治療的敏感性。因此,,研究團(tuán)隊(duì)創(chuàng)新性設(shè)計(jì)了一種半人工細(xì)菌焦亡誘導(dǎo)劑(SBP),,用于逆轉(zhuǎn)腫瘤微環(huán)境的代謝重編程。這種SBP基于硫化銅(CuS)和細(xì)菌細(xì)胞壁主要成分脂多糖(LPS)構(gòu)建,,通過(guò)仿生礦化獲得具有類細(xì)菌免疫刺激特性與光熱消融功能的納米顆粒(LPS@CuS SBP),,實(shí)現(xiàn)代謝干預(yù)與免疫激活的雙重功能。

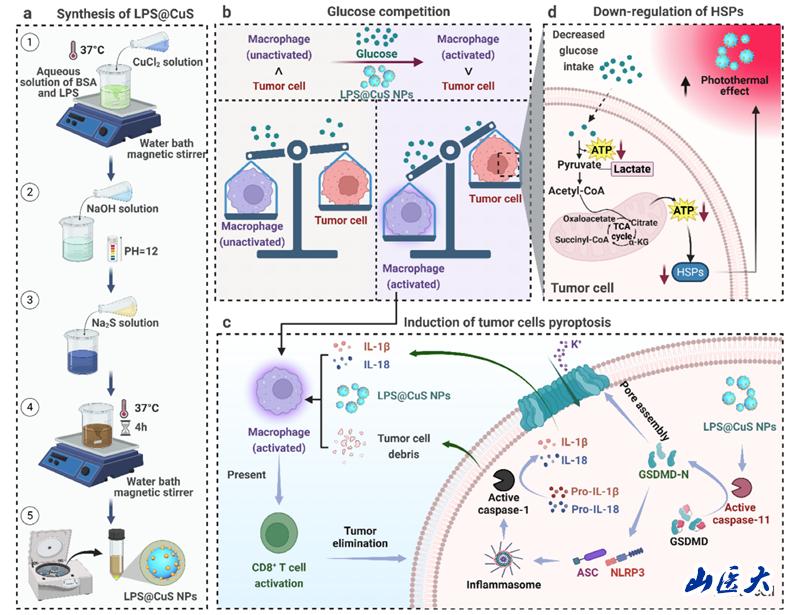
LPS@CuS SBP的制備流程及光熱-免疫協(xié)同作用機(jī)制示意圖
細(xì)胞與動(dòng)物水平的機(jī)制研究表明,,LPS@CuS SBP可顯著增強(qiáng)巨噬細(xì)胞活性,,增強(qiáng)其與腫瘤細(xì)胞的葡萄糖競(jìng)爭(zhēng),從而降低腫瘤細(xì)胞內(nèi)ATP生成及熱休克蛋白(HSPs)表達(dá),,抑制腫瘤細(xì)胞在熱刺激下的自我修復(fù)能力,,從而為光熱治療創(chuàng)造理想微環(huán)境。同時(shí),,LPS@CuS SBP可誘導(dǎo)腫瘤細(xì)胞發(fā)生非經(jīng)典焦亡,,釋放白細(xì)胞介素-6(IL-6)、IL-18等促炎因子,,并激活抗原呈遞細(xì)胞(APCs),,促使其在腫瘤區(qū)域富集。在近紅外(NIR)激光照射下,,LPS@CuS SBP通過(guò)光熱效應(yīng)殺傷腫瘤細(xì)胞,,觸發(fā)腫瘤抗原及腫瘤壞死因子-α(TNF-α)、IL-1β,、IL-6等細(xì)胞因子的釋放,。上述釋放因子與焦亡產(chǎn)生的細(xì)胞碎片協(xié)同介導(dǎo)APCs的成熟活化,使其能夠高效呈遞抗原至CD8+ T細(xì)胞,。最終,,活化的CD8+ T細(xì)胞顯著增強(qiáng)腫瘤殺傷效能,實(shí)現(xiàn)腫瘤的清除,。該成果為逆轉(zhuǎn)腫瘤免疫抑制微環(huán)境提供了創(chuàng)新解決方案,,隨著進(jìn)一步優(yōu)化,LPS@CuS SBP有望成為高效,、低毒的腫瘤免疫治療候選方案,,助力精準(zhǔn)醫(yī)學(xué)發(fā)展。
(圖文/王德平)
復(fù)審復(fù)校:王卓
終審終校:侯小寶