祁金順團隊與合作者揭示Trichostatin A改善阿爾茨海默病的新機制
2021年1月4日,,國際阿爾茨海默病協(xié)會(ADI)會刊《Alzheimer's Research & Therapy》發(fā)表了我校細胞生理學教育部重點實驗室祁金順教授阿爾茨海默病研究團隊與信管學院賀培鳳教授健康大數(shù)據(jù)團隊合作開展的研究成果《Trichostatin A ameliorates Alzheimer's disease-related pathology and cognitive deficits by increasing albumin expression and Aβ clearance in APP/PS1 mice》(曲古抑菌素A通過增加白蛋白表達和清除Aβ改善阿爾茨海默病APP/PS1小鼠相關病理特征和認知障礙),。
阿爾茨海默病(Alzheimer’s disease, AD)是一種難治性神經(jīng)退行性疾病,,臨床上以漸進性認知功能減退為主要表現(xiàn),,目前尚無有效的治療藥物,。腦內(nèi)淀粉樣β蛋白(Aβ)沉積是AD的一個重要神經(jīng)病理學特征,也是誘導AD發(fā)生發(fā)展的主要致病因素,。研究認為,,Aβ的產(chǎn)生和清除之間的失衡是導致Aβ異常聚集和沉積的主要原因,。因此,促進腦內(nèi)和外周的Aβ清除,,是一種有效的AD防治策略,。研究團隊基于多組學數(shù)據(jù)藥物挖掘的疾病—藥物關聯(lián)平臺進行藥物重定位后初步發(fā)現(xiàn),一種組蛋白去乙?;敢种苿?/span>曲古抑菌素A(Trichostatin A,,TSA)具有治療阿爾茨海默病的潛能。隨后,,團隊成員利用AD轉(zhuǎn)基因動物和多種行為學實驗手段,觀察了慢性腹腔注射TSA對APP/PS1小鼠的短期識別記憶和長期空間記憶的改善效應,;通過聯(lián)合應用免疫熒光,、免疫印跡和Simoa技術,研究了TSA對APP/PS1小鼠海馬組織中Aβ沉積以及對Aβ清除相關蛋白表達的影響,;通過綜合運用免疫共沉淀,、質(zhì)譜以及細胞培養(yǎng)等技術,進一步探究了TSA促進Aβ清除的分子機制,。
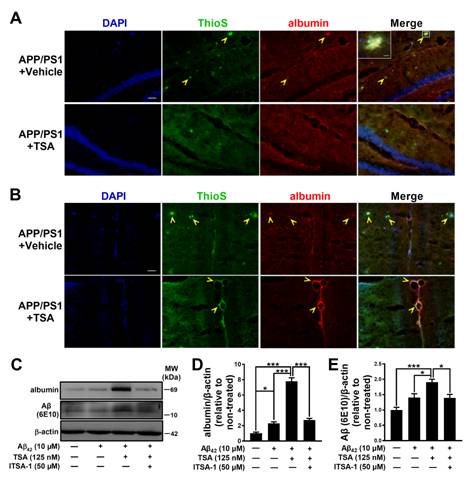
Albumin與Aβ復合物在APP/PS1小鼠大腦鐮血管表達,,促進Aβ低聚物的內(nèi)吞
研究發(fā)現(xiàn),經(jīng)TSA干預之后,,阿爾茨海默病APP/PS1轉(zhuǎn)基因小鼠腦內(nèi)的Aβ斑塊沉積及可溶性Aβ寡聚體含量顯著減少,,AD小鼠的學習和記憶功能也得以有效改善;離體細胞學實驗進一步發(fā)現(xiàn),,TSA增強腦內(nèi)小膠質(zhì)細胞的吞噬作用以及微血管內(nèi)皮細胞的內(nèi)吞,、轉(zhuǎn)運功能,從而增加了腦內(nèi)Aβ的清除能力,;特別是,,該研究首次報道了TSA可顯著上調(diào)小膠質(zhì)細胞和內(nèi)皮細胞血清白蛋白(Albumin)的表達水平,這可能是TSA抑制Aβ聚集,、促進Aβ轉(zhuǎn)運并最終改善阿爾茨海默病病理特征及認知功能的重要機制,。
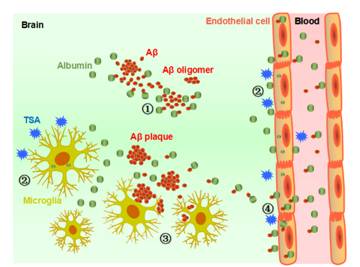
TSA增強Albumin表達,繼而抑制了Aβ的聚集,、增強了小膠質(zhì)細胞對Aβ的吞噬以及微血管內(nèi)皮細胞對Aβ的內(nèi)吞和向往周轉(zhuǎn)運功能
該發(fā)現(xiàn)有助于人們對阿爾茨海默病腦內(nèi)病理特征發(fā)生機制的理解,,同時也為TSA用于阿爾茨海默病臨床治療轉(zhuǎn)化研究提供了寶貴的實驗證據(jù)。
我校博士生蘇強和青年教師李甜為并列第一作者,,祁金順教授,、賀培鳳教授和盧學春教授為共同通信作者。