基礎(chǔ)醫(yī)學(xué)院杜江鋒教授團(tuán)隊(duì)與合作者《Advanced Functional Materials》發(fā)表研究成果:具有催化性能的鎢酸錳納米棒介導(dǎo)化學(xué)動(dòng)力治療聯(lián)合放療治療三陰性乳腺癌
三陰性乳腺癌(TNBC)約占全部乳腺癌的15-20%,由于其高侵襲性的生物學(xué)行為和精準(zhǔn)治療靶點(diǎn)的缺乏,臨床現(xiàn)有治療手段治療效果不佳,,預(yù)后常較其他亞型的乳腺癌更差,。因此,,亟需針對(duì)三陰性乳腺癌的新的治療策略,。
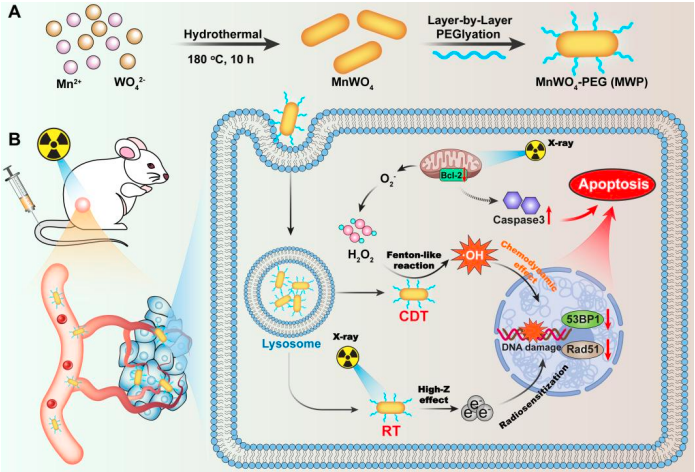
圖1 MWP合成示意圖和協(xié)同CDT/RT治療三陰性乳腺癌過程
2023年6月20日,,山西醫(yī)科大學(xué)基礎(chǔ)醫(yī)學(xué)院/藥學(xué)院/第一臨床醫(yī)學(xué)院杜江鋒教授團(tuán)隊(duì)與合作者發(fā)表的題為“Catalytic MnWO4 Nanorods for Chemodynamic Therapy Synergized Radiotherapy of Triple Negative Breast Cancer”的研究論文被《Advanced Functional Materials》(IF 19.92)雜志接收(EMID: a38ad786be4fd7a8),。該研究設(shè)計(jì)合成一種新型化學(xué)動(dòng)力制劑和放療增敏劑——具有催化性能的鎢酸錳納米棒(MWP NRs),,用于TNBC的協(xié)同化學(xué)動(dòng)力學(xué)/放療(CDT/RT)治療,。MWP NRs中的Mn2+可在H2O2和HCO3-存在的條件下,觸發(fā)腫瘤被動(dòng)靶向的類芬頓效應(yīng),。此外,,其順磁性也可用于癌癥影像學(xué)診斷。另一方面,,MWP NRs中存在高原子序數(shù)W(Z=74),,可以增加腫瘤部位的X射線沉積進(jìn)而增敏RT。同時(shí),,RT也增加了輻照腫瘤中的H2O2水平,,提高了CDT的底物水平,從而促進(jìn)了·OH的產(chǎn)生,。最終,,MWP NRs在CDT/RT協(xié)同作用下產(chǎn)生細(xì)胞凋亡并有效抑制了腫瘤(圖1)。
體外通過ESR和MB褪色反應(yīng)驗(yàn)證了MWP NRs在H2O2和HCO3-存在的條件下可產(chǎn)生類芬頓效應(yīng),,且其催化效率與反應(yīng)溫度,、pH和MWP NRs濃度呈相關(guān)關(guān)系(圖2)。
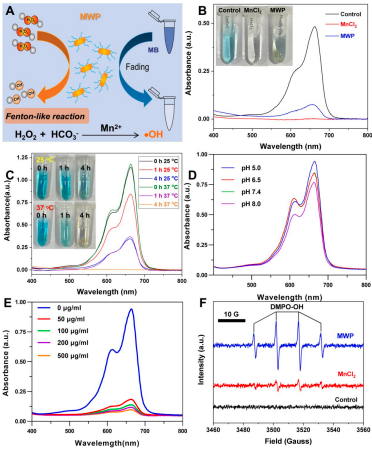
圖2 MWP介導(dǎo)的類芬頓效應(yīng)及其影響因素考察情況
細(xì)胞水平考察了X射線對(duì)4T1細(xì)胞H2O2水平的影響,,結(jié)果如圖3所示:經(jīng)過X射線輻照后,,4T1細(xì)胞上清液及細(xì)胞質(zhì)中的H2O2水平發(fā)生變化,并隨著輻射劑量的增加,,H2O2水平出現(xiàn)了較為明顯的提升,。
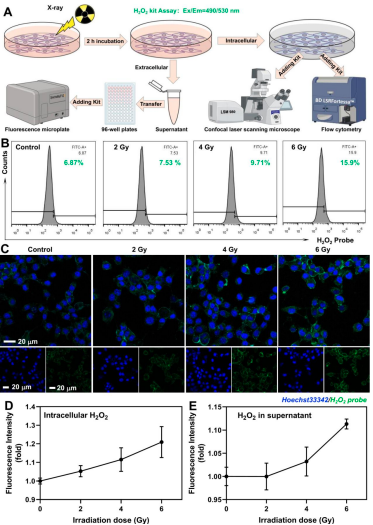
圖3 X射線提高4T1細(xì)胞H2O2水平情況檢測(cè)
為探究CDT/RT協(xié)同治療的潛在機(jī)制,本研究通過激光共聚焦顯微成像,、qPCR,、WB等方法,發(fā)現(xiàn)MWP NRs可能通過影響DNA雙鏈損傷修復(fù)過程(HR及NHEJ途徑)進(jìn)而延緩DNA損傷修復(fù),,最終將細(xì)胞周期調(diào)整至放療敏感的G2/M期,,產(chǎn)生有效的放療增敏效應(yīng),增敏比可達(dá)1.45(圖4),。
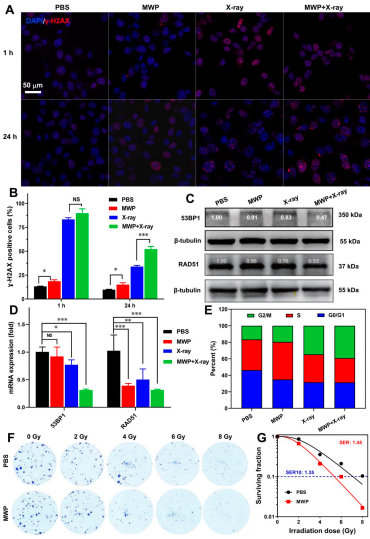
圖4 MWP NRs介導(dǎo)CDT/RT協(xié)同治療潛在機(jī)制
最后通過體內(nèi)實(shí)驗(yàn)考察MWP NRs介導(dǎo)的協(xié)同治療有效性,,結(jié)果如圖5所示:CDT/RT聯(lián)合治療可有效抑制腫瘤的生長,腫瘤抑制率高達(dá)80.4%,。同時(shí),,對(duì)分組治療后的腫瘤組織進(jìn)行切片后可見:聯(lián)合治療組具有更為稀疏的細(xì)胞核分布、低表達(dá)的Ki67和與之對(duì)應(yīng)的高表達(dá)的cleaved Caspase 3和TUNEL水平。此外,,治療過程并未對(duì)小鼠體重造成明顯影響,,表明MWP NRs具有良好的生物安全性。
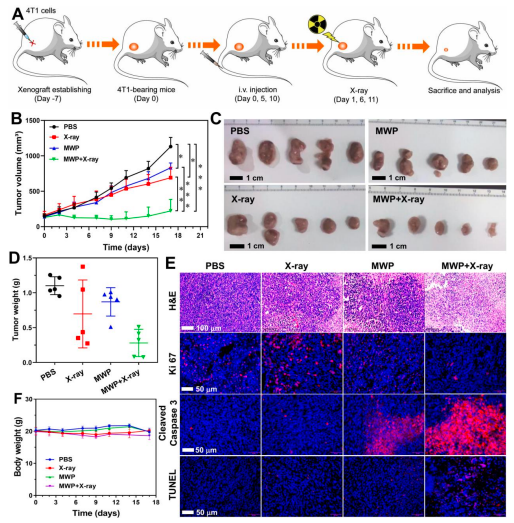
圖5 體內(nèi)水平MWP NRs介導(dǎo)CDT/RT協(xié)同治療三陰性乳腺癌
MWP NRs作為一種新型化學(xué)動(dòng)力學(xué)制劑和放療增敏劑首次被報(bào)道用于協(xié)同CDT/RT治療TNBC,。MWP NRs介導(dǎo)的CDT/RT協(xié)同治療,,通過Mn觸發(fā)類芬頓反應(yīng)擾亂細(xì)胞內(nèi)氧化還原穩(wěn)態(tài),通過損害HR和NHEJ途徑延緩RT誘導(dǎo)的DSB修復(fù),,并將細(xì)胞周期調(diào)整至放射敏感的G2/M期,;W元素介導(dǎo)放療增敏和輻照腫瘤部位H2O2水平提升以增敏CDT,最終達(dá)到有效抑制三陰性乳腺癌的目的,。最重要的是,,MWP NRs合成簡單、組分單一,、可重復(fù)性強(qiáng),,為其臨床轉(zhuǎn)化提供了堅(jiān)實(shí)的基礎(chǔ)。
這項(xiàng)研究的第一作者是山西醫(yī)科大學(xué)基礎(chǔ)醫(yī)學(xué)院基礎(chǔ)醫(yī)學(xué)2020級(jí)碩士趙斌,,共同第一作者是山西醫(yī)科大學(xué)藥學(xué)院2021級(jí)碩士馬智力,。山西醫(yī)科大學(xué)基礎(chǔ)醫(yī)學(xué)院/藥學(xué)院/第一臨床醫(yī)學(xué)院杜江鋒教授,中國人民解放軍陸軍軍醫(yī)大學(xué)第一附屬醫(yī)院/金鳳實(shí)驗(yàn)室田甘教授,、張瀟教授為共同通訊作者,。該研究獲國家自然科學(xué)基金(81971747,81901889,,31900996),、重慶市自然科學(xué)基金(cstc2020jcyj-msxmX0061)、西南醫(yī)院啟動(dòng)經(jīng)費(fèi)(41CZDN),、山西省重點(diǎn)研發(fā)計(jì)劃(201903D121110)等項(xiàng)目資助,。